臨床試験市場規模
世界の臨床試験市場規模は、2024年には767億米ドルと評価され、2025年には807億1,000万米ドルから2033年には1,320億5,000万米ドルに達すると予測されており、予測期間(2025~2033年)中は年平均成長率(CAGR)6.3%で成長すると見込まれています。
臨床試験とは、新薬、治療法、医療機器などの医療介入がヒトにおいてどの程度有効であるかを検証するために、綿密に設計された研究調査です。治療法が広く使用される前に、その安全性と有効性を判断するために不可欠です。
これらの試験は段階的に実施され、それぞれに独自の目的があります。
-
第1相:安全性に焦点を当て、少人数の被験者を対象に新しい治療法を試験し、副作用と投与量を評価します。
-
第2相:安全性を継続的にモニタリングしながら、治療法の有効性を評価します。
-
第3相:より大規模な被験者集団を対象に、新しい治療法と既存の治療法を比較します。
-
第4相:治療法が承認された後に実施され、長期的な効果と安全性をモニタリングします。
臨床試験は厳格なプロトコルに従い、参加者の安全と科学的正確性を確保するために規制当局の監督を受けます。これらの研究は、特定の適格基準を満たす個人の自発的な参加に依存しており、多くの場合、参加者は最先端の治療を受けることができます。世界的な臨床試験市場の拡大を推進する主な要因は、特に慢性疾患や複雑な疾患に対する世界的な医療ニーズの急増と、個別化医療および精密医療への関心の高まりです。
臨床試験市場のトレンド
分散型臨床試験(DCT)の導入
DCTでは、遠隔医療、ウェアラブルデバイス、モバイルアプリ、eConsentなどのテクノロジーを用いて、従来の臨床現場の外で試験を実施します。これにより、遠隔地からの患者参加が可能になり、アクセスの向上、被験者募集の促進、脱落率の低減、試験期間の短縮が可能になります。
-
例えば、ファイザー社によるアトピー性皮膚炎の完全バーチャル試験では、モバイルテクノロジーを用いて遠隔患者モニタリングとバーチャルコンサルテーションを実現し、DCTアプローチと整合することでアクセシビリティと効率性を向上させました。
このように、DCTはアクセシビリティを向上させ、プロセスを合理化し、患者の定着率を向上させ、臨床研究をより効率的かつ包括的なものにします。
患者中心の試験設計への重点の移行
患者中心の試験設計は、参加者の全体的な体験の向上に重点を置き、参加者のニーズ、好み、そして健康状態が試験プロセスの中心となるようにします。このアプローチには、柔軟なプロトコル、個別化されたケア、そしてコミュニケーションを強化し参加者の負担を軽減するためのテクノロジーの活用が含まれます。
-
例えば、ヤンセンの「臨床試験における患者の声」プログラムでは、試験設計プロセスに患者を積極的に参加させ、彼らの意見を集めることで試験プロトコルの改善、患者のエンゲージメント向上、そして試験が患者のニーズや希望により合致したものとなるよう努めています。
このように、患者中心の試験設計は、参加者の体験を向上させ、エンゲージメントを高め、臨床試験の成果を向上させます。
市場概要
| 市場指標 | 詳細とデータ (2024-2033) |
|---|---|
| 2024 市場評価 | USD 76.70 Billion |
| 推定 2025 価値 | USD 80.71 Billion |
| 予測される 2033 価値 | USD 132.05 Billion |
| CAGR (2025-2033) | 6.3% |
| 支配的な地域 | 北米 |
| 最も急速に成長している地域 | アジア太平洋 |
| 主要な市場プレーヤー | Pharmaceutical Product Development, INC. (Thermo Fisher Scientific, Inc.), ICON plc, Charles River Laboratories International, Inc., IQVIA, SYNEOS HEALTH |

このレポートについてさらに詳しく知るには 無料サンプルをダウンロード
レポートの範囲
| レポート指標 | 詳細 |
|---|---|
| 基準年 | 2024 |
| 研究期間 | 2021-2033 |
| 予想期間 | 2026-2034 |
| 急成長市場 | アジア太平洋 |
| 最大市場 | 北米 |
| レポート範囲 | 収益予測、競合環境、成長要因、環境&ランプ、規制情勢と動向 |
| 対象地域 |
|
臨床試験市場の成長要因
臨床試験件数の急増
臨床試験件数の増加は、市場の主要な牽引力であり、多様な治療領域における新たな治療法や治療法への需要の高まりを反映しています。製薬会社とバイオテクノロジー会社は、満たされていない医療ニーズに対応するために研究パイプラインを拡大しており、臨床試験活動の急増につながっています。
2018年から2025年までの登録臨床試験件数は、2019年から2025年(現在まで)にかけて8.18%増加すると予測されています。
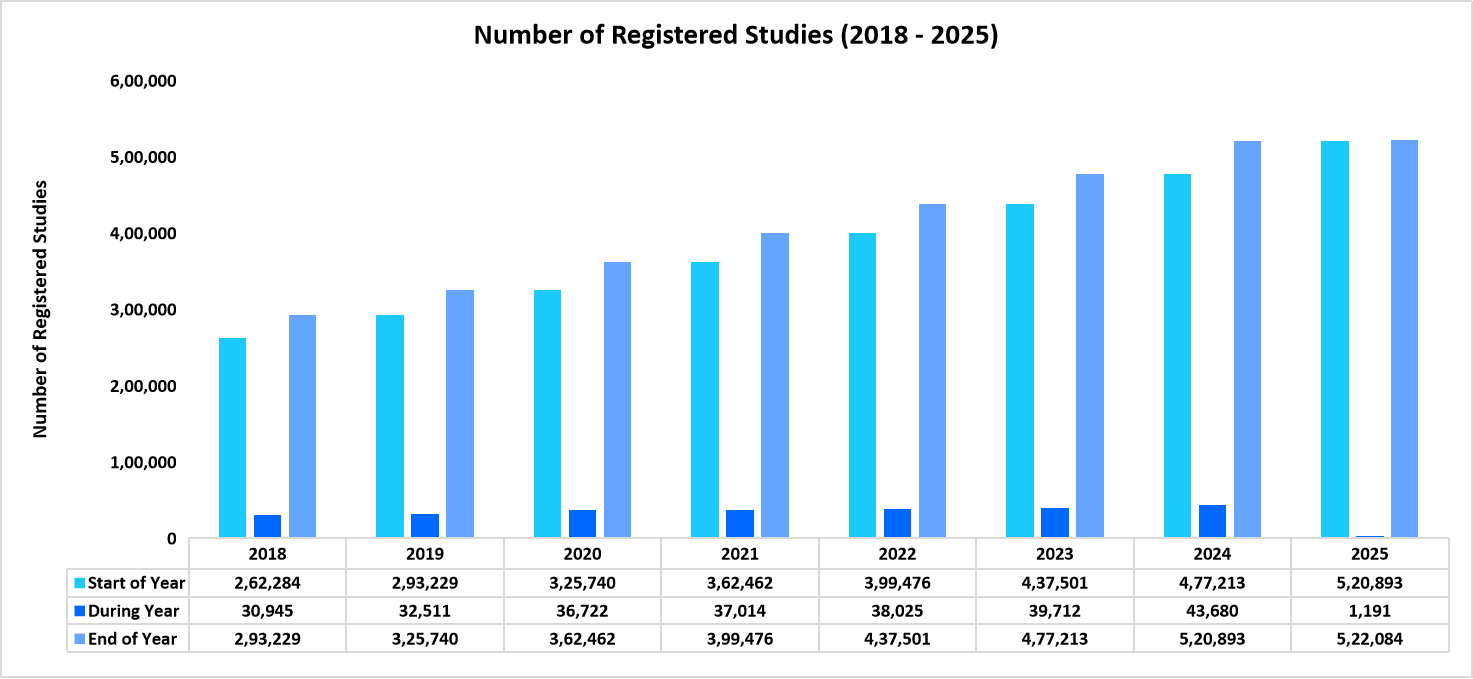
出典: ClinicalTrials.gov
このように、この上昇傾向は、新たな治療法の需要、技術の進歩、そして様々な治療領域における研究活動の拡大によって促進される臨床試験の需要の増加を示しており、最終的には臨床試験市場の成長に貢献しています。
臨床試験のグローバル化
臨床試験のグローバル化は、多様な患者集団へのアクセスを可能にし、被験者募集の課題を軽減し、コストを削減することで、市場の拡大を促進します。これにより、研究期間が短縮され、多国間の連携が促進され、規制当局の承認が迅速化され、新しい治療法の市場アクセスが拡大します。
-
WHOが2024年6月に発表したデータによると、西太平洋地域で登録された試験件数(23,250件)は、アフリカ(845件)の約14倍でした。この差は主に、試験登録を必要とする中国の学術誌、政府系資金提供機関、大学、病院の増加に伴い、中国における試験登録件数が非常に多いことに起因しています。
このように、臨床試験のグローバル化は、患者アクセスの拡大、コストの削減、そして医薬品開発の迅速化に向けた国際協力の促進を通じて、市場の成長を加速させます。
市場の抑制要因
患者の募集と維持の問題
患者の募集と維持は、臨床試験業界において依然として重要な課題であり、医薬品開発のスピードと成功を大きく阻害しています。参加者不足や高い脱落率は、試験のタイムラインに支障をきたし、データの完全性を損なうだけでなく、コストの増加にもつながります。
-
Emmes Company, LLC のホワイトペーパー(2023年9月)によると、臨床試験の85%以上が試験完了までに十分な参加者を確保できていません。
-
同様に、Md Group の記事(2020年10月)では、経済的な負担、時間的な制約、理解や関与の欠如、長距離移動、ストレス、不安、家族の事情などにより、約30%の患者が試験完了前に脱落していると報告されています。
こうした脱落は、遅延、重要なデータの損失、そして代わりの参加者を募集するための経済的負担につながります。 MJH Life Sciences(2023年4月)が指摘しているように、失われた被験者1名を補充するための平均コストは19,533ドルであり、被験者募集プロセスにさらなる負担をかけています。
これらの課題に対処することは、臨床試験の効率性、費用対効果、そして成功率を向上させるために不可欠です。患者エンゲージメント戦略の改善、財政支援、そして柔軟なスケジュール設定は、これらの問題を軽減するのに役立ちます。
市場機会
開発業務受託機関(CRO)の拡大
開発業務受託機関(CRO)の存在感の高まりは、業務の効率化、コスト削減、そして医薬品開発のタイムラインの加速化を実現し、臨床試験業界に変革をもたらす機会をもたらしています。 CROは、規制遵守、患者募集、データ管理、試験実施における専門知識を提供し、製薬会社が研究とイノベーションに集中できるようにします。
- サーモフィッシャーサイエンティフィック社(2023年7月)は、欧州のバイオテクノロジー企業が機能サービスプロバイダー(FSP)モデルを採用するCROと提携したと報告しました。このパートナーシップにより、薬事関連業務、メディカルライティング、データ管理などの機能全体でリソースが効率化されました。その結果、提供までの期間は50日以上からわずか36日に短縮され、迅速な拡張と効率的なリソース配分が可能になりました。
CROのグローバルな展開を活用することで、製薬会社は患者アクセスの向上、試験の効率化、そしてイノベーションの促進を実現できます。この連携により、新薬の市場投入が加速され、すべてのステークホルダーにとってWin-Winのシナリオが実現します。
フェーズインサイト
フェーズIIIセグメントは、大規模な患者参加と、新規治療法の安全性と有効性を確認する上での重要な役割により、世界市場をリードしています。このフェーズでは、規制当局の承認に必要な包括的なデータが生成されるため、医薬品開発の成功に不可欠です。フェーズIII試験に伴う多額の費用とリソースは、治療の信頼性を確保し、公衆衛生ニーズに効果的に対応する上での重要性をさらに強調しています。
治療領域インサイト
がん罹患率の増加と革新的な治療法への切迫したニーズを背景に、オンコロジーセグメントは世界の臨床試験市場を牽引しています。がん研究と医薬品開発への多額の投資に加え、標的療法と免疫腫瘍学の進歩が、この分野の臨床試験を加速させています。効果的ながん治療ソリューションへの高い需要は、このセグメントの優位性を強化し、喫緊の世界的健康課題への取り組みにおける重要な役割を浮き彫りにしています。
設計に関する洞察の研究
介入セグメントは、管理された条件下での治療効果と安全性の評価に広く採用されているため、市場をリードしています。これらの試験は、規制当局の承認に必要な堅牢なデータを生成するために不可欠です。介入研究の構造化されたアプローチは一貫性を確保し、研究者が治療効果をより正確に評価することを可能にします。医薬品開発の礎として、このセグメントはイノベーションを推進し、新しい医療介入の信頼性を高めます。
サービスタイプに関する洞察
臨床試験データ管理サービスは、臨床データの正確性、完全性、およびセキュリティを確保する上で重要な役割を果たすことから、市場を支配しています。試験がますます複雑化する中で、効果的なデータ管理は業務を効率化し、規制基準への準拠を確保し、リアルタイムの洞察を提供します。これらのサービスは、膨大なデータセットを効率的に処理できるようにすることで、意思決定の迅速化と試験結果の向上をサポートし、現代の臨床研究に欠かせないものとなっています。
企業の市場シェア
市場の主要企業は、サービス提供の強化、地理的プレゼンスの拡大、そして競争力の強化を目指し、戦略的提携、買収、そしてパートナーシップを積極的に推進しています。企業は、CRO、学術機関、そしてバイオテクノロジー企業との提携を活用し、業務の効率化と医薬品開発期間の短縮を図っています。
Clinipace(caidya):グローバル臨床試験市場における新興プロバイダー
Clinipace(現在はCaidyaにブランド名変更)は、臨床試験業界の新興リーダーであり、次世代治療法の進歩に向けた革新的なアプローチで高く評価されています。同社は特に、がんに対する免疫応答を強化するための新たなチェックポイント経路を標的とする、最先端のLAG-3免疫療法で知られています。この画期的な進歩により、Caidyaは腫瘍学研究、特に急速に進化する免疫腫瘍学の分野において、重要な貢献者としての地位を確立しています。
地域別インサイト
北米は、先進的な医療インフラ、研究開発への多額の投資、そして大手製薬企業やバイオテクノロジー企業の存在に支えられ、臨床試験の世界市場において37.60%という最大の収益シェアを占めています。北米は、支援的な規制枠組み、多様な患者層、そして試験管理における最先端技術の広範な導入といった恩恵を受けています。これらの要因により、北米は革新的な臨床研究と迅速な医薬品開発のための世界的な拠点としての地位を確立しています。
米国の臨床試験市場動向
- 米国 米国は、堅牢な医療インフラ、多額の研究開発投資、そして数多くの大手製薬企業に支えられ、市場をリードしています。試験管理、規制サポート、データ分析を提供するCROが集中している米国には、国内外の製薬企業が集まっています。この確立されたエコシステムは臨床試験プロセスを効率化し、革新的な医薬品開発を可能にし、米国の優位性を維持しています。
アジア太平洋地域の臨床試験市場動向
アジア太平洋地域は、医療分野の急成長、臨床研究への投資増加、そして患者数の増加を背景に、予測期間中に最も高いCAGRを示すことが予想されています。中国、日本、インドなどの国々は、規制環境の改善と費用対効果の高い運営において重要な役割を果たし、世界的な臨床試験を誘致しています。インフラの整備と革新的な治療法への需要の高まりにより、アジア太平洋地域は臨床試験業界における主要な成長ドライバーとしての地位をさらに強化しています。
- 日本:日本の臨床試験業界は、高齢化、高度な医療インフラ、そして最先端の医療研究への注力によって急速な成長を遂げています。日本は、規制の整った臨床試験環境と、広範な学術機関および病院ネットワークを背景に、アジアにおける臨床研究のリーダーとなっています。がん治療、再生医療、そして個別化医療に重点を置くことで、世界市場における日本の役割をさらに強化しています。
- 中国:中国は、大規模かつ多様な患者層、新たな治療法への需要の高まり、そして改善された規制環境により、世界市場における主要プレーヤーとして台頭しています。医療インフラの急速な拡大と、臨床研究を促進するための政府の優遇措置により、中国は特にがん、心血管疾患、感染症における臨床試験の魅力的な実施地となっています。
- インド:インドは、人口の多様性、医療意識の高まり、そして費用対効果の高い試験実施に牽引され、臨床試験市場として最も急速に成長している国の一つです。数多くの病院や研究機関を擁する、整備された医療インフラは、臨床試験の拡大を支えています。規制プロセスの課題はあるものの、規制簡素化に向けた政府の取り組みと臨床研究への外国投資の増加は、新興市場リーダーとしてのインドの役割を強化しています。
- オーストラリア:オーストラリアの臨床試験産業は、強固な規制枠組み、質の高い医療システム、そして世界クラスの研究機関を特徴としています。特に腫瘍学、神経学、免疫学における国際的な臨床試験への参加は、多様な患者層と高度な医療技術へのアクセスに支えられています。オーストラリア政府は研究と臨床試験に対して大きなインセンティブを提供しており、市場の成長をさらに促進しています。
欧州臨床試験市場動向
- 英国:英国の強力な医療インフラ、経験豊富な研究機関、そして堅牢な規制枠組みが市場を牽引しています。国民保健サービス(NHS)は多様な患者層を提供し、政府による医療イノベーションへの支援と簡素化された規制が成長を促進しています。学術機関、バイオテクノロジー企業、製薬企業間の連携により、英国は最先端の治療法や療法の開発における主要プレーヤーとしての地位を強化しています。
- ドイツ:ドイツは、先進的な医療システム、適切に規制された研究環境、そして強力な製薬産業に支えられ、欧州の臨床試験市場で際立った存在となっています。広範な病院と研究センターのネットワークは、腫瘍学、神経学、心臓学における臨床試験を促進しています。高度なスキルを持つ労働力とイノベーション促進に重点を置く政府により、ドイツは臨床研究の主要拠点としての評判をさらに高めています。
- フランス:フランスの市場は、腫瘍学、免疫学、希少疾患への注力によって活況を呈しています。強力な医療制度、多様な患者層、そして多数の臨床試験センターが成長を牽引しています。確立された規制枠組みと多国籍研究イニシアチブへの積極的な参加は、フランスの世界的な地位を高めています。さらに、研究開発支援とプロセスの合理化に向けた政府の取り組みにより、フランスは臨床研究における主要プレーヤーとなっています。
地域別成長の洞察 無料サンプルダウンロード
臨床試験市場のトップ競合他社
- Pharmaceutical Product Development, INC. (Thermo Fisher Scientific, Inc.)
- ICON plc
- Charles River Laboratories International, Inc.
- IQVIA
- SYNEOS HEALTH
- SGS SA
- PAREXEL International Corporation
- Wuxi AppTec, Inc
- Chiltern International Ltd (Laboratory Corporation of America)
- Eli Lilly and Company
- Novo Nordisk A/S
- Pfizer
- Clinipace (Caidya)
- Medpace
- Frontage Labs
最近の動向
- 2025年1月~ シカゴ大学医学部は、全身性エリテマトーデス、炎症性筋炎、全身性硬化症などの自己免疫疾患に対するCAR-T細胞療法の有用性を検証する第2相臨床試験を開始しました。CAR-T細胞療法は2017年にFDA(米国食品医薬品局)により特定の血液がんに対する適応で承認されましたが、現在、これらの慢性疾患の治療における可能性について研究が進められています。
アナリストの見解
当社のアナリストによると、慢性疾患の有病率増加、バイオテクノロジーの進歩、そして個別化医療と革新的治療法への需要の高まりを背景に、世界市場は力強い成長を遂げています。新興市場における医療インフラの拡大と、治験プロセスの合理化を目的とした規制改革が相まって、市場の発展をさらに加速させています。
さらに、AIやビッグデータ分析といった先進技術の導入は業界を変革し、治験の効率性向上、コスト削減、そして世界中での治験のスケーラビリティ向上をもたらしています。しかしながら、特に患者の募集と維持においては依然として課題が残っており、高い離脱率と多様な患者層へのアクセスの制限が治験のタイムラインに影響を与え、コスト増加につながっています。
地域間の規制の違いも大きなハードルとなっており、企業は複雑なコンプライアンス環境を乗り越える必要があります。これらの課題を克服することは、市場の成長と成功を維持するために不可欠です。
臨床試験市場の市場区分
フェーズ別
- フェーズI
- フェーズII
- フェーズIII
- フェーズIV
治療領域別
- 感染症
- 疼痛管理
- 腫瘍学
- 中枢神経系疾患
- 代謝
- 心血管
- その他
試験デザイン別
- 介入試験
- 観察試験
- 拡大アクセス試験
サービスタイプ別
- プロトコル設計
- 施設選定
- 患者募集
- 検査サービス
- 臨床試験データ管理サービス
- その他
地域別
- 北アメリカ
- ヨーロッパ
- APAC
- 中東諸国とアフリカ
- LATAM
Our Clients:










































