細胞・遺伝子治療製造におけるQC市場規模
世界の細胞・遺伝子治療製造におけるQC市場規模は、2024年には22億4,000万米ドルと推定され、2025年の28億2,000万米ドルから2033年には175億5,000万米ドルに成長すると予測されており、予測期間(2025~2033年)中に年平均成長率(CAGR)25.7%で成長すると見込まれています。
市場を牽引する主な要因は、細胞・遺伝子治療(CGT)のパイプラインの拡大、細胞・遺伝子治療を含む先進治療医薬品(ATMP)セクターへの投資増加、そしてCAR-T細胞療法の治験件数の増加です。さらに、CGT製品に対する規制要件により、CGT療法の安全性と有効性を確保するための堅牢なQCサービスの需要が高まっています。さらに、治療薬開発者の増加は、アウトソーシングによるQCサービス、自動化、AIを活用した分析の導入を促進し、コンプライアンスの合理化と効率性の向上にもつながっています。
さらに、次世代シーケンシング(NGS)、多属性法(MAM)、バイオセーフティ試験への投資は、この分野におけるQCの将来をさらに形作っています。業界が世界的な需要の高まりに対応するために生産規模を拡大するにつれ、市場は拡大を続け、革新的な治療薬の安全性、有効性、そして規制遵守を確保していくでしょう。このグラフは、北米、ヨーロッパ、アジア太平洋、その他の地域における遺伝子治療、GMCT & CBIO、細胞治療の開発者の分布を示しています。遺伝子治療における北米の優位性と、GMCT & CBIOにおけるヨーロッパの強力な存在感が浮き彫りになっています。 CBIOと細胞療法開発。
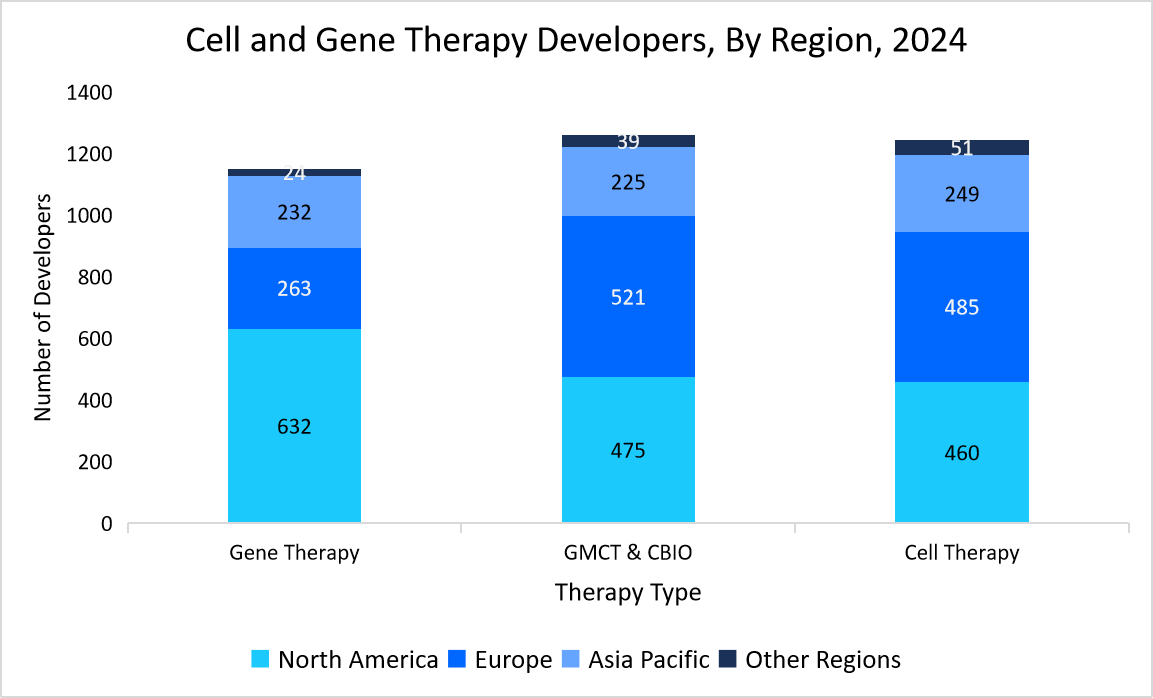
出典:Alliance for Regenerative Medicine、Straits Research
細胞・遺伝子療法製造におけるQC市場動向
QC業務のアウトソーシング:CGT製造における効率の最適化
CGTメーカーは生産と商業化の加速に注力しており、専門の受託研究機関(CRO)や受託開発機関にQC業務をアウトソーシングしています。細胞・遺伝子治療企業(CDMO)への委託が重要なトレンドになりつつあります。
- 例えば、以下のグラフは、英国の細胞・遺伝子治療企業によるQCアウトソーシングの導入状況を示しています。
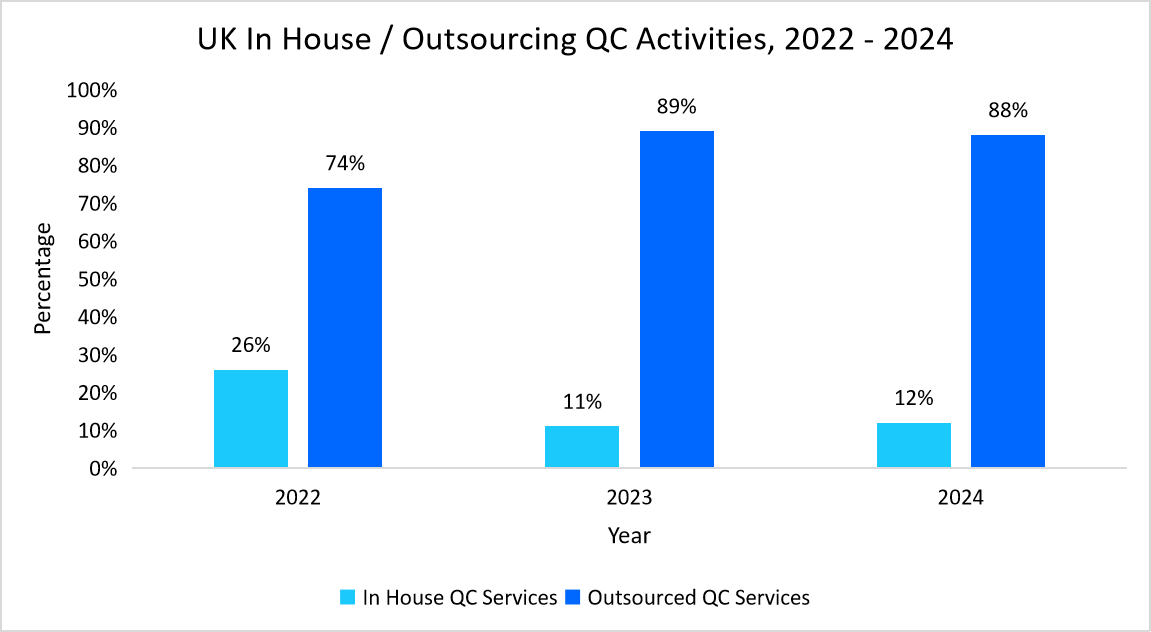
出典:細胞・遺伝子治療カタパルトレビューレポート、Straits Research
したがって、このトレンドは、効率性の向上、コンプライアンスの確保、そして顧客体験の向上を目的とした外部パートナーシップへの戦略的シフトを反映しています。 CGT製造を効率化します。
AIを活用したリアルタイム分析:CGT製造における品質管理の変革
リアルタイム分析とAI主導の洞察の統合は、意思決定の強化、プロセス効率の向上、規制遵守の確保を通じて、細胞・遺伝子治療製造における品質管理を変革しています。
- 例えば、TetraScienceのScientific Data and AI Cloudは、機器やシステムからのリアルタイムデータを統合し、品質管理チームがAI主導の洞察を適用して、より迅速かつ信頼性の高い意思決定を行うことを可能にします。
このように、この傾向は、事後対応型QC戦略から予防型QC戦略への移行を促進し、製品の安全性を向上させ、市場投入までの時間を短縮しています。
市場概要
| 市場指標 | 詳細とデータ (2024-2033) |
|---|---|
| 2024 市場評価 | USD 2.24 Billion |
| 推定 2025 価値 | USD 2.82 Billion |
| 予測される 2033 価値 | USD 17.55 Billion |
| CAGR (2025-2033) | 25.7% |
| 支配的な地域 | 北米 |
| 最も急速に成長している地域 | アジア太平洋 |
| 主要な市場プレーヤー | WuXi AppTec, Lonza, Thermo Fisher Scientific, Charles River Laboratories, Catalent |

このレポートについてさらに詳しく知るには 無料サンプルをダウンロード
レポートの範囲
| レポート指標 | 詳細 |
|---|---|
| 基準年 | 2024 |
| 研究期間 | 2021-2033 |
| 予想期間 | 2026-2034 |
| 急成長市場 | アジア太平洋 |
| 最大市場 | 北米 |
| レポート範囲 | 収益予測、競合環境、成長要因、環境&ランプ、規制情勢と動向 |
| 対象地域 |
|
細胞・遺伝子治療製造におけるQC市場の推進要因
急増する投資がCGT製造におけるQCの進歩を加速
細胞・遺伝子治療製造への投資増加は、規制当局や業界の要求を満たすためのQCインフラ、技術、そして人材育成の進歩を促進しています。
- 例えば、次のグラフは、細胞・遺伝子治療を含む再生医療への投資増加(2022年から2024年)を示しており、QCサービスの需要増加を浮き彫りにしています。
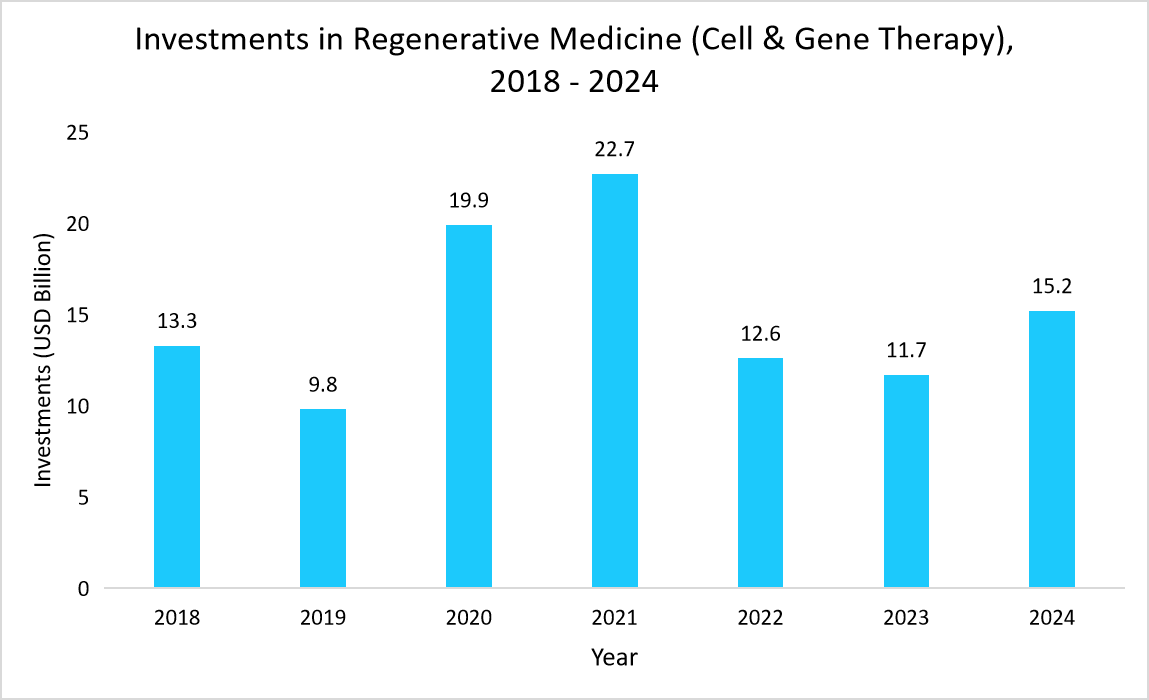
出典:Alliance for Regenerative Medicine、Straits Research
このように、CGT製造への投資の増加は、品質管理インフラの進歩を加速させ、堅牢な品質基準、規制遵守、そしてスケーラブルな生産を確保しています。
CGT製造に関する規制要件
厳格な規制要件は、厳格なコンプライアンスと安全基準を確保することで、細胞・遺伝子治療製造における品質管理分野の成長を促進しています。高度な治療用製品は非常に複雑で、患者にとって健康上のリスクと安全上の懸念があるため、治療に使用するには厳格な管理とコンプライアンスが必要です。 FDAやEMAを含む世界中の規制当局は、細胞・遺伝子治療の開発、製造、商業化を規制する包括的な枠組みとガイドラインを策定しています。
- 例えば、2024年1月、FDA生物製剤評価研究センター(CBE)は、遺伝子治療製品およびキメラ抗原受容体(CAR)T細胞製品の開発に関するガイドラインを発行しました。
- 同様に、EMAによる共同臨床評価と2025年から開始される厳格なガイドラインは、標準化され検証された効力および同一性試験の需要を促進しています。
このように、規制政策と厳格なガイドラインは、堅牢な品質管理対策の需要を加速させ、細胞・遺伝子治療製造業界の成長を促進しています。
市場の抑制要因
拡大するスキルギャップと労働力不足
拡大するスキルギャップと労働力不足は、市場の成長を阻害する主な要因です。業界が急速に進化を続ける中、高度なスキルと経験を持つQC専門家の需要は供給を上回っており、深刻な人材不足の課題が生じ、市場の成長を抑制しています。
- 例えば、Charles River Laboratoriesが2023年5月に発表した記事によると、COVID-19パンデミックが続く中、大手メーカー3社によるCAR-T関連の求人広告数は、2019年から2020年にかけて123件から203件へと倍増しました。
- さらに、Alliance for Regenerative Medicineの2023年3月の報告書によると、米国の細胞・遺伝子治療セクターは、労働力不足を補うため、2025年までに商業化と研究開発の分野で32,000人以上の労働者を雇用すると予想されています。
このように、スキルギャップと労働力不足は大きな課題であり、市場の成長と拡張性を制限しています。
市場機会
細胞・遺伝子治療製品のパイプライン拡大
急速に拡大する細胞・遺伝子治療製品のパイプラインは、市場にとって大きな機会をもたらし、コンプライアンス、安全性、有効性を確保するための高度な試験ソリューションの需要を促進しています。細胞・遺伝子治療候補製品が開発段階を進み、商業化に近づくにつれて、包括的な品質管理試験と検証の需要が大幅に増加し、品質管理サービスの需要も高まります。
- 例えば、以下の表は、2023年から2024年にかけて実施されている遺伝子治療の臨床試験をいくつか示しています。この表は、遺伝子治療の件数が2,093件(2024年第1四半期)から2,117件(2024年第4四半期)に増加し、QC技術の需要が高まっていることを示しています。
遺伝子治療パイプライン、2024年
| グローバル | 2024年第1四半期 | 2024年第2四半期 | 2024年第3四半期 | 2024年第4四半期 |
| 前臨床 | 1,471 | 1,436 | 1,393 | 1,424 |
| フェーズI | 301 | 314 | 318 | 341 |
| フェーズII | 282 | 279 | 289 | 306 |
| フェーズIII | 35 | 34 | 35 | 35 |
| 事前登録 | 4 | 5 | 6 | 11 |
| 合計 | 2,093 | 2,068 | 2,041 | 2,117 |
出典:米国遺伝子細胞治療学会(ASGCT)、Straits Research
このように、CGTパイプラインの拡大は、規制遵守、安全性、および有効性を確保するための高度なQC試験の必要性を高めています。
治療タイプ分析
市場は、細胞療法(CAR-T細胞(自家CAR-T細胞、同種CAR-T細胞)、CAR-NK細胞、B細胞、その他)と遺伝子療法(ウイルス療法(AAV、レンチ、その他)、非ウイルス療法)に分類されます。遺伝子療法セグメントは、FDAおよびEMAによる遺伝子療法の承認件数の増加、遺伝子療法パイプラインの拡大、そして遺伝子療法の純度と効力に関する厳格なガイドラインが堅牢な品質管理サービスの必要性を高めていることから、予測期間中に最も高いCAGRを記録すると予想されます。
規模分析
市場は、プレコマーシャル/研究開発段階の製造とコマーシャル規模の製造に分類されます。プレコマーシャル/研究開発段階の製造セグメントは2024年に市場を席巻し、予測期間中に最も高いCAGRを記録すると予想されます。この成長は、臨床試験中の細胞・遺伝子治療製品の増加、自家細胞および他家細胞治療プラットフォーム、そして後期臨床試験における高い失敗率によって商業化前段階の活動が活発化していることに牽引されています。
モード分析
市場は、受託製造と自社製造に分かれています。受託製造セグメントは、高度な分析技術を備え、規制基準に準拠したCDMOへの品質管理プロセスのアウトソーシングが急増しているため、予測期間中に最も高いCAGRを記録すると予想されています。
ワークフローインサイト
市場は、細胞処理、細胞バンキング、プロセス開発、充填・仕上げ工程、原材料試験、ベクター製造、その他のワークフローに分類されています。ベクター製造セグメントは、遺伝子置換療法の需要増加により、2024年には最大のシェアを占めると予想されます。これにより、ベクターの品質と効率を確保する必要性が高まり、ひいてはベクター製造QCサービスの需要が高まります。
プロセス分析
市場は、上流プロセスと下流プロセスに分類されます。下流プロセスセグメントは、バイオプロセス技術の進歩による下流プロセスの改善、高純度CGT製品の需要増加、そして受託製造組織の拡大が相まってセグメントの成長を牽引しているため、予測期間中に25.3%という最も高いCAGRを記録すると予想されます。
エンドユーザーインサイト
市場は、製薬会社、バイオ医薬品/バイオテクノロジー企業、受託製造組織に分類されます。 2024年には、ノバルティスやギリアド・サイエンシズといった大手製薬企業が細胞・遺伝子治療のパイプライン候補を増やし、バイオ製薬企業間の連携が拡大したことで、バイオ医薬品/バイオテクノロジー企業が市場を席巻しました。
テクノロジーインサイト
市場は、蛍光活性化細胞選別法(FACS)、酵素結合免疫吸着法(ELISA)、クロマトグラフィー、次世代シーケンシング(NGS)、ポリメラーゼ連鎖反応(PCR)などに分類されます。ポリメラーゼ連鎖反応(PCR)は、遺伝子組み換えや汚染物質の検出における高い感度、迅速な処理能力、そして規制遵守により、市場を席巻しました。正確な定量のためのqPCRとdPCRの導入、そして標準化された効力および同一性アッセイの需要の高まりも、このセグメントの成長にさらに貢献しています。
企業市場シェア
業界の主要企業は、市場で確固たる地位を築くため、戦略的提携、買収、事業拡大といった主要なビジネス戦略の採用に注力しています。
Solvias:細胞・遺伝子治療製造品質管理市場における新興企業
Solviasは、細胞・遺伝子治療(CGT)のメソッド開発、バリデーション、安定性試験、規制遵守サポートを専門とする、市場の新興企業です。
Solviasの最近の動向:
- 2025年1月、グローバルリーダーであるSolviasは、ノースカロライナ州リサーチ・トライアングル・パーク(RTP)の中心部に、生物製剤および細胞・遺伝子治療のためのセンター・オブ・エクセレンスを開設することを発表しました。
地域別インサイト
北米:市場シェア38.6%を誇る主要地域
北米は、強力な規制枠組み(FDAガイドライン)、多額の研究開発投資、高度な品質管理インフラ、そして豊富なCGT製品のパイプラインにより、細胞・遺伝子治療製造における品質管理市場において主導的な地位を占めています。主要業界プレーヤーの存在、広範な臨床試験、そして政府の資金援助が市場の成長をさらに促進し、品質管理プロセスにおけるコンプライアンスとイノベーションを確実なものにしています。
アジア太平洋地域:市場CAGRが最も高い、最も急成長している地域
アジア太平洋地域は、予測期間中に26.3%という最も高いCAGRで成長すると予想されています。これは、中国、日本、韓国などの国の政府や民間企業がバイオテクノロジーインフラに積極的に投資し、細胞・遺伝子治療の導入を加速させていることが要因です。さらに、先進的な治療法に対する需要の高まり、受託開発の拡大、そして製造組織の拡大が、この地域におけるQCサービスのニーズを牽引しています。
各国の見解
細胞・遺伝子治療製造におけるQCセクターは、世界中でダイナミックな成長と多様化を遂げており、各国がそれぞれ独自の視点でこの変革的な分野の発展に貢献しています。
- 米国 - 米国は、FDAの厳格な規制、広範な臨床試験活動、そして先進的なQC技術への多額の投資によって、細胞・遺伝子治療製造におけるQC業界を牽引しています。大手CGTメーカー、専門のQCサービスプロバイダー、そして学術研究機関の存在が、継続的なイノベーションを促進しています。さらに、バイデン政権のARPA-HやNIHの再生医療プログラムといった取り組みは、QCの進歩と商業化への取り組みを加速させています。
- カナダ - カナダの市場は、強力なイノベーション、戦略的パートナーシップ、そして政府の支援により拡大しています。Catamaran BioとOmniaBioによるCAR-NK療法の開発や、オタワ病院へのバイオ医薬品への5,900万ドルの資金提供といった提携は、QCサービスの需要を押し上げています。さらに、カナダ保健省が2025年1月にDLBCL治療薬としてBMS社のBreyanziを承認するなど、規制当局による承認件数が増加していることから、CGT製造における厳格な品質管理(QC)対策の必要性が高まっています。
- ドイツ - ドイツのCGTセクターは、活気のあるバイオテクノロジー・エコシステム、活発な研究開発、そして膨大な数のCGT臨床試験に牽引され、急速に成長しています。さらに、ドイツはCGTの製造と普及を促進するための新たな国家戦略を策定しており、QCサービスの需要をさらに押し上げています。下のグラフは、CGT臨床試験件数の増加を示しており、厳格な品質管理対策の必要性が高まっていることを浮き彫りにしています。
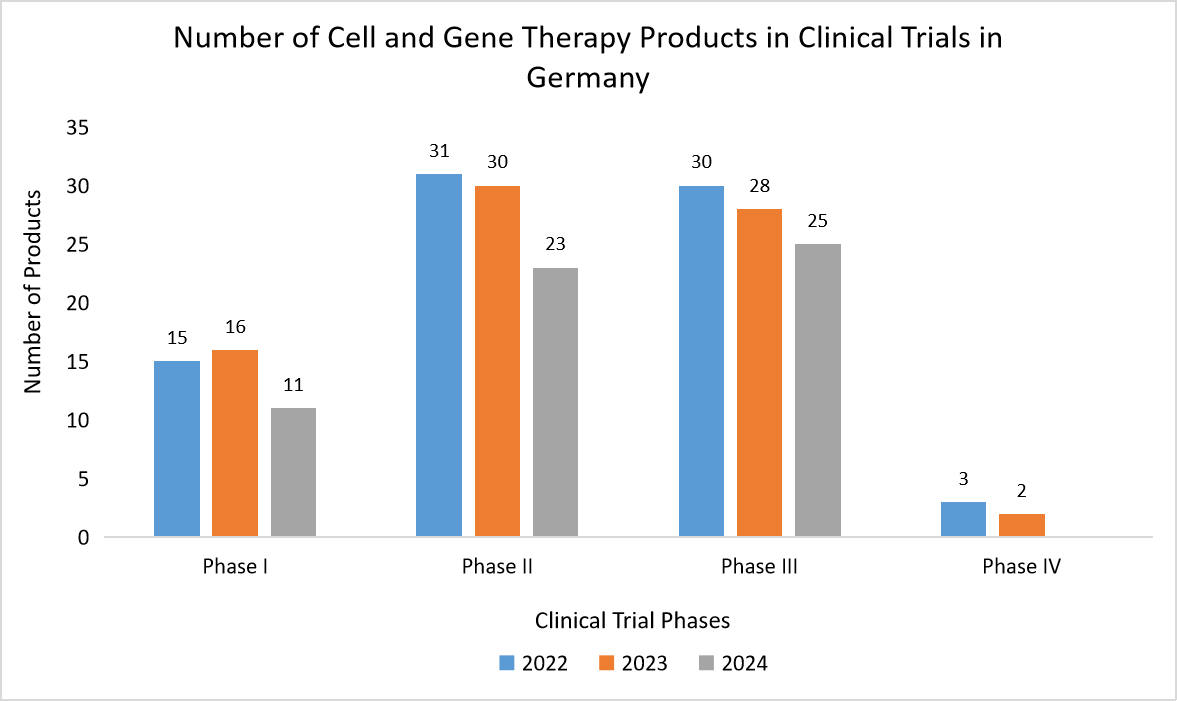
出典:Clinical Trials.gov、Straits Research
- フランス - フランスの市場は、強力な政府支援、戦略的投資、そして先駆的な研究イニシアチブによって牽引されています。 「Plan France Méeacute;decine Génomique 2025」や88億ドルのヘルスケアイノベーションプラン2030などのプログラムはCGTの進歩を促進し、11億8000万ドルがバイオメディカル研究に充てられています。イノベーションが加速し、複数の治療法が開発を進めるにつれ、堅牢なQCサービスの需要は高まり続けています。
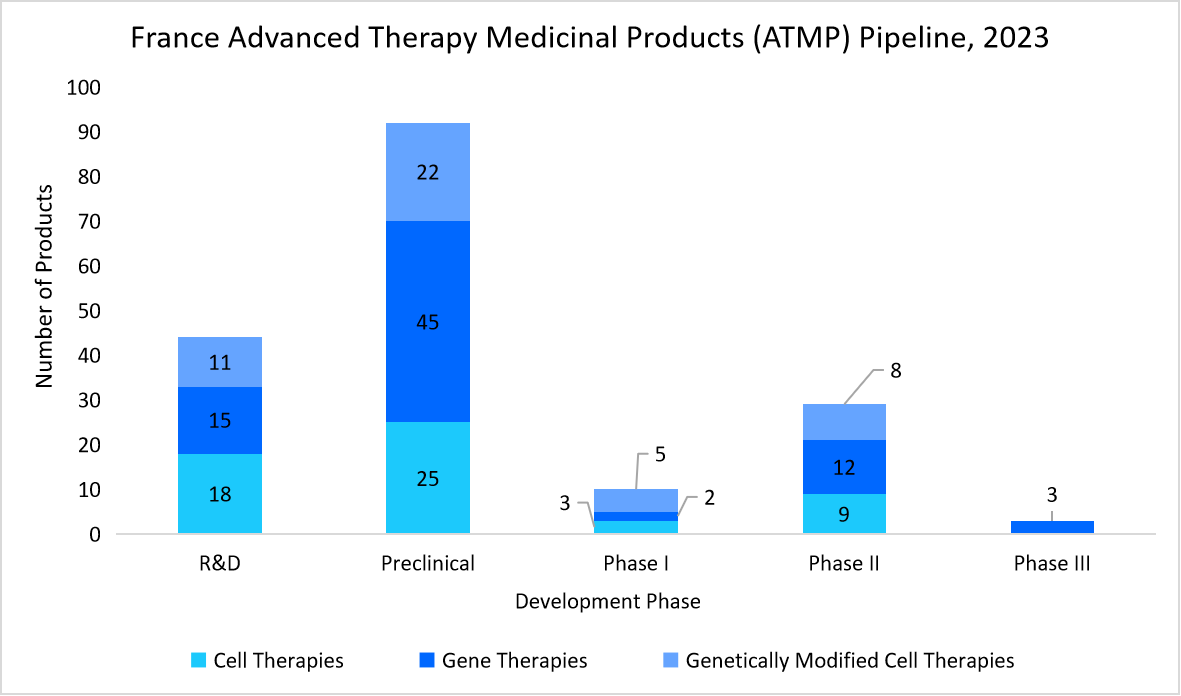
出典:Health Innovation Agency、Straits Research
- 英国:英国市場の成長を牽引する主な要因は、CGTセクターへの投資の増加、GMP製造施設の拡張、そして承認件数の増加です。例えば、下のグラフは、施設面積が2020年の20,500 m²から2024年には51,862 m²に増加することを示しています。これは、業界の大規模生産ニーズを反映しており、細胞・遺伝子治療分野を含むATMP製造への投資増加を示しています。
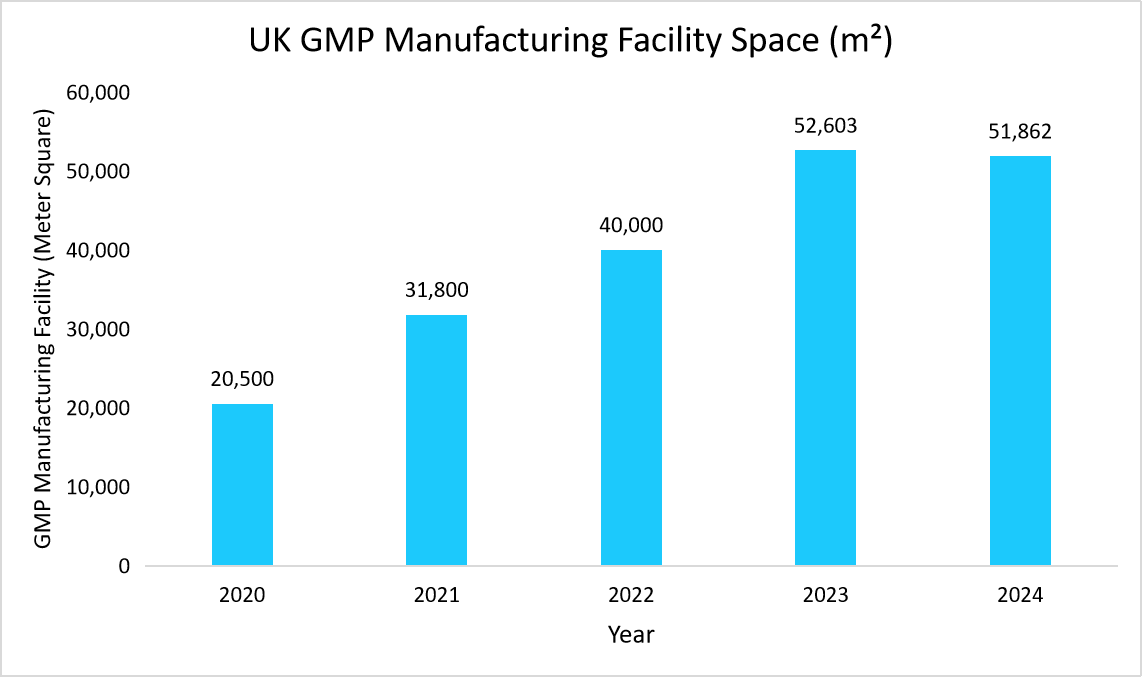
出典:Cell and Gene Therapy Catapult Review Reports、Straits Research
- 中国 - 中国市場は、臨床試験の急増とCGTパイプラインの増加に牽引され、急速に拡大しています。国立バイオテクノロジー情報センター(National Center for CGT)によると、2023年2月時点で、CGTパイプラインは2010年から2022年にかけて17%増加しました。中国におけるCAR-T細胞療法への注力と規制当局による承認の増加は、スケールアップ製造における品質管理サービスの需要をさらに押し上げています。細胞療法関連の試験2,034件のうち、1,164件はCAR-T療法に関するもので、そのうち11件はピボタル段階にあり、2件はNMPAに新薬承認申請(NDA)を提出済みです。この急速な進展は、商業化を支えるための堅牢な品質管理対策の必要性が高まっていることを浮き彫りにしています。
地域別成長の洞察 無料サンプルダウンロード
細胞・遺伝子治療製造QC市場のトップ競合他社
- WuXi AppTec
- Lonza
- Thermo Fisher Scientific
- Charles River Laboratories
- Catalent
- Merck KGaA
- Eurofins Scientific
- Pace
- Pharmaron
- BioAgilytix Labs
- Avance Biosciences
- SGS
- IQVIA
- Alcami Corporation
- Solvias
- Pacific BioLabs
- ProtaGene
- Laboratory Corporation of America Holdings
- AGC Biologics
- uBriGene Biosciences International Co.
最近の進展
- 2025年3月、アルフレッサ ホールディングス株式会社とミナリス再生医療株式会社は、日本における細胞治療製品の臨床および商業生産を支援することを目指し、細胞治療の開発および製造に関する協力覚書(MoU)を締結しました。
- 2025年1月、 キャタレント社はガラパゴスNVと提携し、再発・難治性NHLを対象としたCAR-T療法の治験薬GLPG5101の臨床試験における分散型製造を支援しました。
アナリストの見解
細胞・遺伝子治療薬製造におけるQC市場は、CGT製造に対する厳格な規制要件、自動化およびAIを活用したQCソリューションの導入拡大、CGT製品のパイプライン拡大、そして高度なQCインフラへの投資増加を背景に、大幅な成長を遂げています。さらに、専門のCROやCDMOへのQC業務のアウトソーシングは、コンプライアンスと拡張性の向上に寄与し、リアルタイム分析と予測的品質管理は製造効率の向上に寄与しています。グローバルな連携の拡大と政府の資金援助は、QCプロセスにおけるイノベーションと標準化を支援することで、市場の成長をさらに加速させています。
細胞・遺伝子治療製造QC市場の市場区分
治療の種類別
-
細胞療法
- CAR-T療法
- CAR-NK療法
- B細胞療法
- その他
-
遺伝子療法
- ウイルス療法
- 非ウイルス療法
規模別
- プレコマーシャル/研究開発段階の製造
- 商業規模の製造
モード別
- 受託製造
- 自社製造
ワークフロー別
- 細胞処理
- 細胞バンキング
- 充填・仕上げ工程
- 原材料試験
- ベクター生産
- その他のワークフロー
プロセス別
- 上流工程
- 下流工程
エンドユーザー別
-
製薬会社
- 小規模
- 中規模
- 大規模
-
バイオ医薬品/バイオテクノロジー会社
- 小規模
- 中規模
- 大規模
-
受託製造組織
- 小規模サイズ
- 中サイズ
- 大サイズ
技術タイプ別
- 蛍光活性化細胞選別法(FACS)
- 酵素結合免疫吸着法(ELISA)
- クロマトグラフィー
- 次世代シーケンシング(NGS)
- ポリメラーゼ連鎖反応(PCR)
- その他
地域別
- 北アメリカ
- ヨーロッパ
- APAC
- 中東諸国とアフリカ
- LATAM
Our Clients:










































